دكتور أمجد هزاع
دكتور أمجد هزاع
يتكون سم النحل من العديد من المواد الفعالة وهي مركبات ببتيدية بروتينية انزيمية لها تأثيرات فسيولوجية متعددة أهمها هي مادة الميليتين والتي تشكل ما يقارب %50-55 من نسبة المادة الجافة لسم النحل ، وفيما يلي توضيح لأهم مكونات سم النحل و تركيب سم النحل الكيميائي :
الميليتين (Melittin) هو عديد الببتيد الأساسي لسم النحل مكون من 26 حمضًا أمينيًا، ويشكل متوسط 50% من سم النحل الجافBiologically active peptide 40-60 % of Dry Venom وهي المادة الأكثر فعالية في مستحضر سم النحل. [1], [39], [45]

وقد تم نشر العديد من الأوراق العلمية البحثية والتي تؤكد كل الفوائد العلاجية التي تم ذكرها في القائمة السابقة [5], [6], [7], [8], [9], [10], [11], [12]
يعتبر الميليتين مادة مضادة للالتهاب، والميليتين يخفض دورة أحادي فوسفات الأدينوسين(cAMP)، وتؤكد دراسة نشرت تحت عنوان : التطبيقات المضادة للالتهابات من ميليتين، أحد المكونات الرئيسية لسم النحل: آلية مفصلة للعمل والتأثيرات الضارة، Anti-Inflammatory Applications of Melittin, a Major Component of Bee Venom: Detailed Mechanism of Action and Adverse Effects أن سم النحل يستخدمه النحل لحمايته من الأعداء، ومع ذلك ، فقد تم استخدامه لعدة قرون في الشرق كدواء مضاد للالتهابات لعلاج الأمراض الالتهابية المزمنة. يعتبر سم النحل ومكونه الرئيسي ، ميليتين ، من الوسائل المحتملة للحد من الاستجابات المناعية المفرطة وتوفير بدائل جديدة للسيطرة على الأمراض الالتهابية، وتؤكد هذه الدراسة الأهمية العلاجية للميليتين وآليات عمله التفصيلية ضد العديد من الأمراض الالتهابية بما في ذلك التهاب الجلد والتهاب الأعصاب وتصلب الشرايين والتهاب المفاصل والتهاب الكبد. [13]

حيث يثبط Melittin مسارات TLR2 و TLR4 و CD4 و NEMO و PDGFRβ وبالتالي يمنع عمل الجينات المسببة للالتهابات pro-inflammatory genes وتؤدي هذه العملية إلى انخفاض مستويات الجزيئات المؤيدة للالتهابات وتقليل الالتهاب lower levels of pro-inflammatory molecules and the reduction of inflammation
الاختصارات: TLR2 ، Toll-Like Receptors 2 مستقبلات شبيهة بالرقم 2 ؛ CD4 ، Cluster of Differentiation 4 مجموعة التمايز 4 ؛ NEMO ، nuclear factor kappa-β essential modulator المغير الأساسي للعامل النووي kappa-؛ PDGFRβ ، platelet-derived growth factor receptor β مستقبل عامل النمو المشتق من الصفائح الدموية β
ومن الجدير بالذكر أنه أثبتت الأبحاث العلمية أن الميليتين يرتبط بمجموعة sulfhydryl الخاصة بـ IKKs فيقلل نشاط IKKs و IkappaB و NF-kappaB المسببون للالتهاب ، وهذا يدل على أن سم النحل مادة مضادة للالتهاب ، وخرجت أوراقا تحمل فائدة مادة الميليتين المضادة للالتهاب تحت عنوان Melittin inhibits inflammatory target gene expression and mediator generation via interaction with IkappaB kinase .[14]
يمنع Melittin مسارات إشارات TLR2 و TLR4 و CD14 و NEMO و PDGFRβ. عن طريق تثبيط هذه المسارات ، يقلل الميلتين من تنشيط p38 و ERK1 / 2 و AKT و PLCγ1 بالإضافة إلى انتقال NF-B إلى النواة، حيث يؤدي هذا التثبيط إلى تقليل الالتهاب في أنسجة الجلد والأروتا والمفاصل والكبد والأنسجة العصبية.
الاختصارات: TLR ، مستقبلات تشبه رسوم المرور ؛ قرص مضغوط ، مجموعة التمايز ؛ NEMO ، المغير الأساسي للعامل النووي kappa-B ؛ PDGFRβ ، مستقبل عامل النمو المشتق من الصفائح الدموية بيتا.
أكدت أوراق علمية متعددة على أهمية الميليتين العلاجية وتأثيره البيولوجي حيث يعمل الميليتين على تثبيط بعض النشاطات الانزيمية المرتبطة بغشاء الخلية مثل إنزيمات الأسيتيل كولين استيريزس كما تؤكد احدى الدراسات التي تمت بجامعة ناجويا في اليابان ، كما تؤكد دراسات متعددة أن مادة الميليتين تمنع التوتر السطحي للأغشية، وتعتبر كمضاد للالتهاب في ذاتها وبجرعات قليلة جدا حيث تقوم باثارة العضلات الملساء وتزيد من نشاط الدورة الدموية بزيادة نفاذية الشعيرات الدموية ، وتعمل على تقليل ضغط الدم من خلال عملية ارتخاء الأوعية الدموية كما أكدت أبحاث معهد جوزيف استيفان بسلوفينيا وغيرها .[7], [8], [10], [11], [12], [13], [15], [16], [17], [18], [19], [20], [21], [22], [23], [24], [25], [26], [27], [28], [29], [30], [31], [32], [33], [34], [35], [36], [37], [38], [39], [40], [41], [42], [43], [44], [45], [46], [47], [48]
مادة المليتين مضادة للسرطانات لأنها تقلل نشاط مادة nuclear factor kappaB (NF-kappaB) ولهذا يمكن استخدامه في علاج السرطان خاصة البروستاتا أو الثدي أو الرئة أو المبيض أو المستقيم وغيرها وتشير أبحاث ودراسات مرجعية شاملة الى أن سم النحل ومكونه الرئيسي ميليتين لعلاج السرطان bee venom and its main constituent melittin for cancer treatment
وأفادت الدراسة أن سم النحل ومكونه الرئيسي ميليتين (MEL) على نطاق واسع في علاج الأورام.[5], [6], [16], [20], [25], [28], [48], [49], [50], [51], [52], [53], [54], [55], [56], [57], [58], [59], [60], [61], [62], [63], [64]
ان مادة الميليتين تعتبر المادة الأكثر ألما في سم النحل Melittin, the Major Pain-Producing Substance of Bee Venom على الرغم من أنه يُعرف الكثير عن نشاطه السطحي القوي على الأغشية الدهنية ، إلا أنه لا يُعرف الكثير عن آثاره المسببة للألم في الجهاز العصبي. وغالبا يعتبر الميليتين هو المادة الرئيسية المسببة للألم في سم النحل على المستويين النفسي والبدني والسلوكي ، يسبب الحقن تحت الجلد للمليتين الإحساس بالألم المقوي، وعلى المستوى الخلوي ، ينشط الميلتين خلايا مستقبلات الألم الأولية من خلال التأثيرات المباشرة وغير المباشرة.[10]
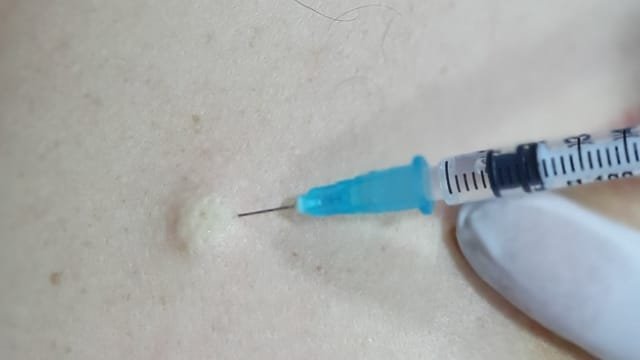
بعد الحقن تحت الجلد subcutaneous injection لتركيز منخفض من الميلتين a low concentration of melittin ، يتم تنشيط فسفوليباز phospholipase A2 ((PLA2 ويحفز إنتاج حمض الأراكيدونيك arachidonic acid (AA) من الفوسفوليبيدات phospholipids ، حيث يتم تحفيز AA أيضًا عن طريق إنزيمات الأكسدة الشحمية lipoxygenases (LOXs) لإنتاج أحماض hydroperoxyeicosatetraenoic (HETEs) التي تعمل كروابط داخلية لفتح قنوات مستقبلات TRPV1 ، مما يؤدي إلى تدفق Ca2+ influx وإزالة استقطاب الغشاء membrane depolarization. وفي الوقت نفسه ، يتم تحفيز AA أيضًا بواسطة انزيمات الأكسدة الحلقية (COXs) cyclooxygenases لإنتاج PGs التي تعزز نشاط TRPV1 ، مما يؤدي إلى توعية مستقبلات الألم الأولية sensitization of the primary nociceptors تماما.
تتضرر مصفوفة الأنسجة والخلايا البدينة بسبب تأثيرها في تكوين المسام ، مما يؤدي إلى إطلاق H + و ATP و HT-5. هذه المواد المسببة للألم تفتح قنوات المستقبلات ذات البوابات الترابطية مثل مستقبلات Purinergic P2X3 ، والقنوات الأيونية المستشعرة للحمض ، و 5-HT3 ، مما يؤدي إلى تدفق الكاتيون. من ناحية أخرى ، ينشط الهيستامين والبراديكينين و ATP الناتج عن تأثير تشكيل المسام على مصفوفة الأنسجة أيضًا GPCRs مثل H1 و P2Y و B1 / B2 التي تؤدي إلى فسفرة PLC. PLC يشق phosphatidylinositol 4،5-bisphosphate في diacyl glycerol (DAG) و inositol 1،4،5-trisphosphate (IP3). DAG هو منشط داخلي من TRPC. عندما يتم تنشيط TRPC بواسطة DAG ، يتم إزالة الاستقطاب من مجموعة سكانية فرعية من خلايا مستقبلات الألم الأولية التي لا تعبر عن TRPV1. كينازات البروتين المنشط بالميتوجين ، بما في ذلك كيناز خارج الخلية منظم بإشارة 1/2 (ERK1 / 2) ، و c-Jun N-terminal kinase (JNK) و p38 MAPK تشارك أيضًا في عملية الألم الناجم عن الميلتين وفرط الحساسية ، ربما من خلال تفعيل PLC كذلك. Indirect
ان الجرعات العالية من المليتين تسبب الالتهاب inflammatory وانحلال الدم haemolytic والتى تزيد على 4mg/kg وهي تعتبر كمية كبيرة . [66]
[1] R. Wehbe, J. Frangieh, M. Rima, D. El Obeid, J. M. Sabatier, and Z. Fajloun, “Bee venom: Overview of main compounds and bioactivities for therapeutic interests,” Molecules, vol. 24, no. 16, Aug. 2019, doi: 10.3390/molecules24162997.
[2] W. Kim, “Bee Venom and Its Sub-Components: Characterization, Pharmacology, and Therapeutics,” Toxins (Basel), vol. 13, no. 3, Mar. 2021, doi: 10.3390/TOXINS13030191.
[3] S. Zhang et al., “Bee venom therapy: Potential mechanisms and therapeutic applications,” Toxicon, vol. 148, pp. 64–73, Jun. 2018, doi: 10.1016/j.toxicon.2018.04.012.
[4] R. Wehbe, J. Frangieh, M. Rima, D. El Obeid, J. M. Sabatier, and Z. Fajloun, “Bee Venom: Overview of Main Compounds and Bioactivities for Therapeutic Interests,” Molecules, vol. 24, no. 16, Aug. 2019, doi: 10.3390/MOLECULES24162997.
[5] P. Erkoc et al., “The Pharmacological Potential of Novel Melittin Variants from the Honeybee and Solitary Bees against Inflammation and Cancer,” Toxins (Basel), vol. 14, no. 12, Dec. 2022, doi: 10.3390/toxins14120818.
[6] H. N. Lim, S. B. Baek, and H. J. Jung, “Bee venom and its peptide component melittin suppress growth and migration of melanoma cells via inhibition of PI3K/Akt/mTOR and MAPK pathways,” Molecules, vol. 24, no. 5, 2019, doi: 10.3390/molecules24050929.
[7] H. Gu et al., “Bee Venom and Its Major Component Melittin Attenuated Cutibacterium acnes-and IGF-1-Induced Acne Vulgaris via Inactivation of Akt/mTOR/SREBP Signaling Pathway,” Int J Mol Sci, vol. 23, no. 6, Mar. 2022, doi: 10.3390/ijms23063152.
[8] L. F. Leandro et al., “Antimicrobial activity of apitoxin, melittin and phospholipase A2 of honey bee (Apis mellifera) venom against oral pathogens,” An Acad Bras Cienc, vol. 87, no. 1, pp. 147–155, Mar. 2015, doi: 10.1590/0001-3765201520130511.
[9] W. G. Lima et al., “Antibacterial, anti-biofilm, and anti-adhesive activities of melittin, a honeybee venom-derived peptide, against quinolone-resistant uropathogenic Escherichia coli (UPEC),” Nat Prod Res, vol. 36, no. 24, pp. 6381–6388, 2022, doi: 10.1080/14786419.2022.2032047.
[10] J. Chen, S. M. Guan, W. Sun, and H. Fu, “Melittin, the Major Pain-Producing Substance of Bee Venom,” Neurosci Bull, vol. 32, no. 3, pp. 265–272, Jun. 2016, doi: 10.1007/s12264-016-0024-y.
[11] H. Memariani and M. Memariani, “Anti-fungal properties and mechanisms of melittin,” Appl Microbiol Biotechnol, vol. 104, no. 15, pp. 6513–6526, Aug. 2020, doi: 10.1007/s00253-020-10701-0.
[12] M. Akbarzadeh-Khiavi, M. Torabi, A. H. Olfati, L. Rahbarnia, and A. Safary, “Bio-nano scale modifications of melittin for improving therapeutic efficacy,” Expert Opin Biol Ther, vol. 22, no. 7, pp. 895–909, 2022, doi: 10.1080/14712598.2022.2088277.
[13] G. Lee and H. Bae, “Anti-inflammatory applications of melittin, a major component of bee venom: Detailed mechanism of action and adverse effects,” Molecules, vol. 21, no. 5, May 2016, doi: 10.3390/molecules21050616.
[14] H. J. Park et al., “Melittin inhibits inflammatory target gene expression and mediator generation via interaction with IkappaB kinase,” Biochem Pharmacol, vol. 73, no. 2, pp. 237–247, Jan. 2007, doi: 10.1016/J.BCP.2006.09.023.
[15] Y. J. Jeong et al., “Melittin has a chondroprotective effect by inhibiting MMP-1 and MMP-8 expressions via blocking NF-κB and AP-1 signaling pathway in chondrocytes,” Int Immunopharmacol, vol. 25, no. 2, pp. 400–405, 2015, doi: 10.1016/j.intimp.2015.02.021.
[16] G. H. Mansour et al., “Bee venom and its active component Melittin synergistically potentiate the anticancer effect of Sorafenib against HepG2 cells,” Bioorg Chem, vol. 116, Nov. 2021, doi: 10.1016/j.bioorg.2021.105329.
[17] X. Xie et al., “Melittin Inhibits Growth of Human Osteosarcoma 143B Cells through Induction of Apoptosis via Suppressing the Wnt/β-catenin Signaling Pathway,” Anticancer Agents Med Chem, vol. 22, no. 18, pp. 3172–3181, May 2022, doi: 10.2174/1871520622666220509121627.
[18] S. Huang, J. Wang, Z. Guo, Y. Wang, and C. Liu, “Quantitative measurement of melittin in Asian honeybee venom using a new method including UPLC-QqTOF-MS,” Toxins (Basel), vol. 12, no. 7, Jul. 2020, doi: 10.3390/toxins12070437.
[19] X. Li et al., “Melittin induces ferroptosis and ER stress-CHOP-mediated apoptosis in A549 cells,” Free Radic Res, vol. 56, no. 5–6, pp. 398–410, 2022, doi: 10.1080/10715762.2022.2131551.
[20] C. cui Liu et al., “Application of bee venom and its main constituent melittin for cancer treatment,” Cancer Chemother Pharmacol, vol. 78, no. 6, pp. 1113–1130, Dec. 2016, doi: 10.1007/s00280-016-3160-1.
[21] B. G. Eid et al., “Melittin and diclofenac synergistically promote wound healing in a pathway involving TGF-β1,” Pharmacol Res, vol. 175, Jan. 2022, doi: 10.1016/j.phrs.2021.105993.
[22] H. Zhukouskaya et al., “Anionically Functionalized Glycogen Encapsulates Melittin by Multivalent Interaction,” Biomacromolecules, vol. 23, no. 8, pp. 3371–3382, Aug. 2022, doi: 10.1021/acs.biomac.2c00400.
[23] P. Bevalian, F. Pashaei, R. Akbari, and K. Pooshang Bagheri, “Eradication of vancomycin-resistant Staphylococcus aureus on a mouse model of third-degree burn infection by melittin: An antimicrobial peptide from bee venom,” Toxicon, vol. 199, pp. 49–59, Aug. 2021, doi: 10.1016/j.toxicon.2021.05.015.
[24] Y. Lv et al., “Melittin Tryptophan Substitution with a Fluorescent Amino Acid Reveals the Structural Basis of Selective Antitumor Effect and Subcellular Localization in Tumor Cells,” Toxins (Basel), vol. 14, no. 7, Jul. 2022, doi: 10.3390/toxins14070428.
[25] K. Daniluk, A. Lange, M. Pruchniewski, A. Małolepszy, E. Sawosz, and S. Jaworski, “Delivery of Melittin as a Lytic Agent via Graphene Nanoparticles as Carriers to Breast Cancer Cells.,” J Funct Biomater, vol. 13, no. 4, Dec. 2022, doi: 10.3390/jfb13040278.
[26] T. Tender, R. R. Rahangdale, S. Balireddy, M. Nampoothiri, K. K. Sharma, and H. Raghu Chandrashekar, “Melittin, a honeybee venom derived peptide for the treatment of chemotherapy-induced peripheral neuropathy,” Medical Oncology, vol. 38, no. 5, May 2021, doi: 10.1007/s12032-021-01496-9.
[27] Y. Miyazaki and W. Shinoda, “Cooperative antimicrobial action of melittin on lipid membranes: A coarse-grained molecular dynamics study,” Biochim Biophys Acta Biomembr, vol. 1864, no. 9, Sep. 2022, doi: 10.1016/j.bbamem.2022.183955.
[28] F. Salimian, M. Nabiuni, and E. Salehghamari, “Melittin Prevents Metastasis of Epidermal Growth Factor-Induced MDA-MB-231 Cells through The Inhibition of The SDF-1α/CXCR4 Signaling Pathway.,” Cell J, vol. 24, no. 2, pp. 85–90, Feb. 2022, doi: 10.22074/cellj.2022.7626.
[29] J. Tusiimire et al., “An LCMS method for the assay of melittin in cosmetic formulations containing bee venom,” Anal Bioanal Chem, vol. 407, no. 13, Mar. 2015, doi: 10.1007/s00216-015-8578-5.
[30] E. Jamasbi, S. S. Lucky, W. Li, M. A. Hossain, P. Gopalakrishnakone, and F. Separovic, “Effect of dimerized melittin on gastric cancer cells and antibacterial activity,” Amino Acids, vol. 50, no. 8, pp. 1101–1110, Aug. 2018, doi: 10.1007/s00726-018-2587-6.
[31] H. D. Vu et al., “Melittin-loaded iron oxide nanoparticles prevent intracranial arterial dolichoectasia development through inhibition of macrophage-mediated inflammation,” Int J Biol Sci, vol. 17, no. 14, pp. 3818–3836, 2021, doi: 10.7150/IJBS.60588.
[32] X. gong Fan et al., “Melittin ameliorates inflammation in mouse acute liver failure via inhibition of PKM2-mediated Warburg effect,” Acta Pharmacol Sin, vol. 42, no. 8, pp. 1256–1266, Aug. 2021, doi: 10.1038/s41401-020-00516-0.
[33] H. Wang, H. Qin, G. Garab, and E. S. Gasanoff, “Short-Chained Alcohols Make Membrane Surfaces Conducive for Melittin Action: Implication for the Physiological Role of Alcohols in Cells.,” Cells, vol. 11, no. 12, Jun. 2022, doi: 10.3390/cells11121928.
[34] S. Ganpule, A. K. Vijaya, A. Sukova, and G. Preta, “Membrane Cholesterol Content and Lipid Organization Influence Melittin and Pneumolysin Pore-Forming Activity,” Toxins (Basel), vol. 14, no. 5, May 2022, doi: 10.3390/toxins14050346.
[35] V. K. Sharma, D. G. Hayes, V. S. Urban, H. O’Neill, M. Tyagi, and E. Mamontov, “Melittin exerts opposing effects on short- and long-range dynamics in bicontinuous microemulsions,” J Colloid Interface Sci, vol. 590, pp. 94–102, May 2021, doi: 10.1016/j.jcis.2021.01.032.
[36] B. Cheng and P. Xu, “Redox-Sensitive Nanocomplex for Targeted Delivery of Melittin,” Toxins (Basel), vol. 12, no. 9, Sep. 2020, doi: 10.3390/toxins12090582.
[37] J. Hong, X. Lu, Z. Deng, S. Xiao, B. Yuan, and K. Yang, “How melittin inserts into cell membrane: Conformational changes, inter-peptide cooperation, and disturbance on the membrane,” Molecules, vol. 24, no. 9, 2019, doi: 10.3390/molecules24091775.
[38] G. Pessenda et al., “Human scFv antibodies (Afribumabs) against Africanized bee venom: Advances in melittin recognition,” Toxicon, vol. 112, pp. 59–67, Mar. 2016, doi: 10.1016/j.toxicon.2016.01.062.
[39] T. Kang et al., “A biomimetic nanoparticle-enabled toxoid vaccine against melittin,” Int J Nanomedicine, vol. 13, pp. 3251–3261, Jun. 2018, doi: 10.2147/IJN.S156346.
[40] T. Tender, R. R. Rahangdale, S. Balireddy, M. Nampoothiri, K. K. Sharma, and H. Raghu Chandrashekar, “Melittin, a honeybee venom derived peptide for the treatment of chemotherapy-induced peripheral neuropathy.,” Med Oncol, vol. 38, no. 5, p. 52, Apr. 2021, doi: 10.1007/s12032-021-01496-9.
[41] E. Jamasbi, A. Mularski, and F. Separovic, “Model Membrane and Cell Studies of Antimicrobial Activity of Melittin Analogues,” Curr Top Med Chem, vol. 16, no. 1, pp. 40–45, Sep. 2015, doi: 10.2174/1568026615666150703115919.
[42] M. G. Enayathullah et al., “Gramicidin S and melittin: potential anti-viral therapeutic peptides to treat SARS-CoV-2 infection.,” Sci Rep, vol. 12, no. 1, p. 3446, Mar. 2022, doi: 10.1038/s41598-022-07341-x.
[43] J. Lubawy et al., “The influence of bee venom melittin on the functioning of the immune system and the contractile activity of the insect heart—a preliminary study,” Toxins (Basel), vol. 11, no. 9, Sep. 2019, doi: 10.3390/toxins11090494.
[44] B. Zorilă, G. Necula, M. Radu, and M. Bacalum, “Melittin Induces Local Order Changes in Artificial and Biological Membranes as Revealed by Spectral Analysis of Laurdan Fluorescence,” Toxins (Basel), vol. 12, no. 11, Nov. 2020, doi: 10.3390/toxins12110705.
[45] C. Lyu, F. Fang, and B. Li, “Anti-Tumor Effects of Melittin and Its Potential Applications in Clinic,” Curr Protein Pept Sci, vol. 20, no. 3, pp. 240–250, Jun. 2018, doi: 10.2174/1389203719666180612084615.
[46] L. Sun, S. Wang, F. Tian, H. Zhu, and L. Dai, “Organizations of melittin peptides after spontaneous penetration into cell membranes,” Biophys J, vol. 121, no. 22, pp. 4368–4381, Nov. 2022, doi: 10.1016/j.bpj.2022.10.002.
[47] F. Jia et al., “Bottlebrush Polymer-Conjugated Melittin Exhibits Enhanced Antitumor Activity and Better Safety Profile,” ACS Appl Mater Interfaces, 2021, doi: 10.1021/acsami.1c14285.
[48] J. Y. Huang et al., “Melittin suppresses epithelial-mesenchymal transition and metastasis in human gastric cancer AGS cells via regulating Wnt/BMP associated pathway,” Biosci Biotechnol Biochem, vol. 85, no. 11, pp. 2250–2262, Nov. 2021, doi: 10.1093/bbb/zbab153.
[49] U. A. Fahmy et al., “Potentiality of raloxifene loaded melittin functionalized lipidic nanovesicles against pancreatic cancer cells,” Drug Deliv, vol. 29, no. 1, pp. 1863–1877, 2022, doi: 10.1080/10717544.2022.2072544.
[50] J. P. Feng et al., “Melittin-encapsulating peptide hydrogels for enhanced delivery of impermeable anticancer peptides,” Biomater Sci, vol. 8, no. 16, pp. 4559–4569, Aug. 2020, doi: 10.1039/c9bm02080b.
[51] I. Rady, I. A. Siddiqui, M. Rady, and H. Mukhtar, “Melittin, a major peptide component of bee venom, and its conjugates in cancer therapy,” Cancer Lett, vol. 402, pp. 16–31, Aug. 2017, doi: 10.1016/j.canlet.2017.05.010.
[52] A. Mahmoodzadeh, H. Zarrinnahad, K. P. Bagheri, A. Moradia, and D. Shahbazzadeh, “First report on the isolation of melittin from Iranian honey bee venom and evaluation of its toxicity on gastric cancer AGS cells,” Journal of the Chinese Medical Association, vol. 78, no. 10, pp. 574–583, Oct. 2015, doi: 10.1016/j.jcma.2015.06.008.
[53] N. Y. Kwon, S. H. Sung, H. K. Sung, and J. K. Park, “Anticancer Activity of Bee Venom Components against Breast Cancer,” Toxins (Basel), vol. 14, no. 7, Jul. 2022, doi: 10.3390/toxins14070460.
[54] G. Gajski and V. Garaj-Vrhovac, “Melittin: A lytic peptide with anticancer properties,” Environ Toxicol Pharmacol, vol. 36, no. 2, pp. 697–705, 2013, doi: 10.1016/j.etap.2013.06.009.
[55] A. Aufschnaiter et al., “Apitoxin and Its Components against Cancer, Neurodegeneration and Rheumatoid Arthritis: Limitations and Possibilities,” Toxins (Basel), vol. 12, no. 2, Feb. 2020, doi: 10.3390/TOXINS12020066.
[56] M. M. Rocha et al., “A new therapeutic approach for bone metastasis in colorectal cancer: intratumoral melittin.,” J Venom Anim Toxins Incl Trop Dis, vol. 28, p. e20210067, 2022, doi: 10.1590/1678-9199-JVATITD-2021-0067.
[57] J. Zhou, C. Wan, J. Cheng, H. Huang, J. F. Lovell, and H. Jin, “Delivery Strategies for Melittin-Based Cancer Therapy.,” ACS Appl Mater Interfaces, vol. 13, no. 15, pp. 17158–17173, Apr. 2021, doi: 10.1021/acsami.1c03640.
[58] A. Wang, Y. Zheng, W. Zhu, L. Yang, Y. Yang, and J. Peng, “Melittin-Based Nano-Delivery Systems for Cancer Therapy,” Biomolecules, vol. 12, no. 1, Jan. 2022, doi: 10.3390/biom12010118.
[59] Y. J. Jeong, Y. Y. Park, K. K. Park, Y. H. Choi, C. H. Kim, and Y. C. Chang, “Bee Venom Suppresses EGF-Induced Epithelial-Mesenchymal Transition and Tumor Invasion in Lung Cancer Cells,” American Journal of Chinese Medicine, vol. 47, no. 8, pp. 1869–1883, 2019, doi: 10.1142/S0192415X19500952.
[60] R. Yu, M. Wang, M. Wang, and L. Han, “Melittin suppresses growth and induces apoptosis of non-small-cell lung cancer cells via down-regulation of tgf-β-mediated erk signal pathway,” Brazilian Journal of Medical and Biological Research, vol. 54, no. 2, pp. 1–9, 2021, doi: 10.1590/1414-431×20209017.
[61] S. Tang et al., “MnO2-melittin nanoparticles serve as an effective anti-tumor immunotherapy by enhancing systemic immune response,” Biomaterials, vol. 288, Sep. 2022, doi: 10.1016/j.biomaterials.2022.121706.
[62] S. Lv, M. Sylvestre, K. Song, and S. H. Pun, “Development of D-melittin polymeric nanoparticles for anti-cancer treatment,” Biomaterials, vol. 277, Oct. 2021, doi: 10.1016/j.biomaterials.2021.121076.
[63] C. Zhou et al., “TERT promoter regulating melittin expression induces apoptosis and G0/G1 cell cycle arrest in esophageal carcinoma cells.,” Oncol Lett, vol. 21, no. 1, p. 16, Jan. 2021, doi: 10.3892/ol.2020.12277.
[64] X. Yu et al., “Melittin-lipid nanoparticles target to lymph nodes and elicit a systemic anti-tumor immune response,” Nat Commun, vol. 11, no. 1, Dec. 2020.
[65] M. Motiei, F. Aboutalebi, M. Forouzanfar, K. Dormiani, M. H. Nasr-Esfahani, and S. Z. Mirahmadi-Zare, “Smart co-delivery of miR-34a and cytotoxic peptides (LTX-315 and melittin) by chitosan based polyelectrolyte nanocarriers for specific cancer cell death induction,” Materials Science and Engineering: C, vol. 128, p. 112258, Sep. 2021, doi: 10.1016/J.MSEC.2021.112258.
[66] J. E. Lee, V. K. Shah, E. J. Lee, M. S. Oh, and J. J. Choi, “Melittin – A bee venom component – Enhances muscle regeneration factors expression in a mouse model of skeletal muscle contusion,” J Pharmacol Sci, vol. 140, no. 1, pp. 26–32, May 2019, doi: 10.1016/j.jphs.2019.03.009.