دكتور أمجد هزاع
دكتور أمجد هزاع
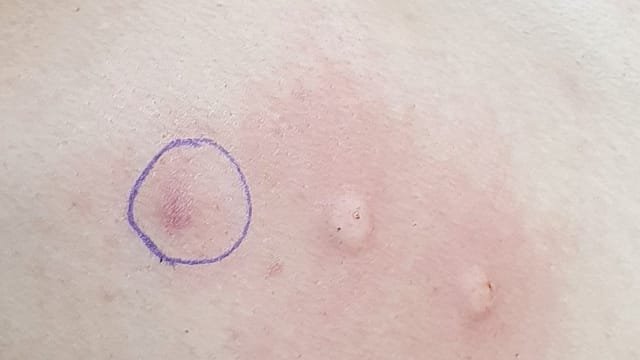
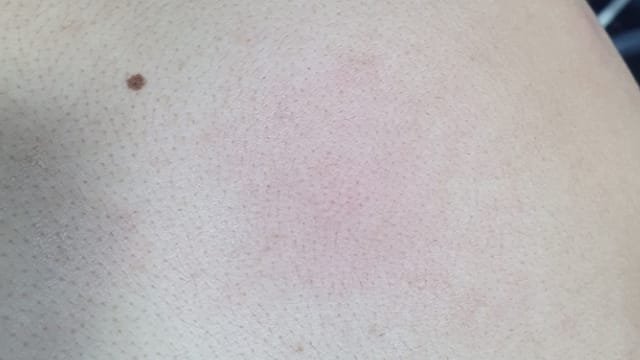
ان حساسية سم النحل لا تعني تورم الموضع الذي تم التعامل معه سواء باللدغ أو بالحقن ، فهذا التفاعل طبيعي من الجسم وكذلك لا تعني ارتفاع نسبي بسيط في درجة حرارة الجسم فهذا تفاعل عضوي يتم التعامل معه من خلال ضبط التركيزات العلاجية المثلى للمريض ولكن حساسية الانسان لسم النحل هي تفاعل جهازي عام يسبب في تغيرات سلبية عامة على مستوى الجسم وينقسم الى تفاعلات جهازية بسيطة وأخرى شديدة
وتشمل نوعين من التفاعل الجهازي العام Systemic Reactions كما يلي:
وهي حالات الحساسية الجهازية البسيطة خلال دقائق بعد اللسعة بتورم الشفتين وتحسس في جميع أنحاء الجسم وقد ينخفض ضغط الدم مع دوخة وغثيان وتقيؤ وبعض الناس يجد صعوبة في التنفس و يتم تناول مضادات الحساسية في صورة حقن أو أقراص Anti-histaminic مع حقن الكورتيزون المائي سريع المفعول (الهيدروكورتيزون) Hydrocortisone أو الكورتيزون المائي .[1]
– هي الحساسية الجهازية الشديدة Severe Systemic Reaction أو صدمة الحساسية Anaphylactic Shock، هي تفاعل مناعي دوري شديد عام وخطير يؤدي الى انخفاض شديد في ضغط الدم ويؤثر في معدل نبضات القلب وقد تبدأ عوارضها بصعوبة بالغة الشدة للتنفس بسبب انضغاط الحلق مع تغير شديد في لون الوجه والعين، وتحتاج الى التدخل السريع والعاجل بمضادات الحساسية القوية ومضادات الالتهاب مثل الهيدروكورتيزون Hydro-Cortisone خاصة . [2], [3], [4], [5]
– قد تؤدي الحساسية الجهازية الشديدة لسم النحل الى الاغماء وتوقف القلب والرئتين بما يتطلب القيام معه بالانعاش القلبي الرئوي CPR (Cardiopulmonary Resuscitation) ، وكذلك استخدام حقن منشط للجهاز العصبي السمبثاوي Sypathetic Nervous System مثل الادرينالين Adrenaline أو الايبينفرين Epinephrine والتواصل بالاسعاف فورا مع استكمال اجراءات اسعاف الحالة وذلك لحين نقل المريض الى غرفة الطواريء بالمستشفيات اذا دعت الحاجة. [4], [6], [7]
ومن المقرر علميا أن سم النحل أكثر سمية من سموم الدبابير، وفى حالات نادرة فإن لسعة واحدة يمكن أن تسبب الموت عن طريق صدمة فرط الحساسية, وهؤلاء الأشخاص ممكن أن يموتوا خلال 30 دقيقة فيما لو لم يتم إسعافهم طبياً بشكل عاجل، حيث عادة ما يتكون هذا العلاج من كمادات ثلج وأدرينالين ومضاد للهستامين. وفى الحالات العادية فإن الشخص الواحد قد يحتاج إلى تلقى 500 لسعة على الأقل وذلك خلال فترة قصيرة لتسبب وفاته بالتسمم المباشر، وهذه الحالة من الحساسية الجهازية الشديدة أو صدمة الحساسية Anaphylactic Shock ربما تصادف الحالة مع الجلسة الأولى للعلاج بسم النحل، ولكن من النادر حدوثها من بعد الجلسة العلاجية الأولى أو أثناء الجلسات العلاجية مهما زادت كمية المادة العلاجية، وخاصة اذا لم يتم رفع التركيزات العلاجية Serum Bee Venom Concentration بصورة تدريجية. [6], [8], [9], [10], [11]

وفي عام 2018م نشرت في الممارسة الارشادية العالمية ورقة علمية اشترك بها عدد كبير من الباحثين حول العالم ، ونشرت تحت عنوان: إرشادات الأكاديمية الأوروبية للحساسية والمناعة السريرية EAACI حول العلاج المناعي للحساسية: حساسية غشائيات الأجنحة، وفي خلاصتها أفادت بأن حساسية غشائيات الأجنحة هي رد فعل تحسسي قد يهدد الحياة بعد لدغة نحل العسل أو داء الزنابق أو لدغة النمل. تم تقرير عن تفاعلات حساسية جهازية في ما يصل إلى 7.5٪ من البالغين وما يصل إلى 3.4٪ من الأطفال. يمكن أن تكون خفيفة ومقتصرة على الجلد أو معتدلة إلى شديدة مع خطر الحساسية المفرطة التي تهدد الحياة. يجب أن يحمل المرضى حقيبة طوارئ تحتوي على حاقن أدرينالين ذاتي ، ومضادات الهيستامين H1 ، والكورتيكوستيرويدات اعتمادًا على شدة تفاعل (تفاعلات) اللدغة السابقة. العلاج الوحيد لمنع المزيد من ردود الفعل الجهازية اللدغة هو العلاج المناعي بالسم. تم إعداد هذا الدليل الإرشادي من قبل فريق العمل التابع للأكاديمية الأوروبية للحساسية والمناعة السريرية (EAACI) بشأن العلاج المناعي للسم كجزء من إرشادات EAACI بشأن مبادرة العلاج المناعي لمسببات الحساسية. يهدف الدليل إلى تقديم توصيات قائمة على الأدلة لاستخدام العلاج المناعي للسم ، وقد تم إطلاعه من خلال مراجعة منهجية رسمية وتحليل تلوي وتم إنتاجه باستخدام نهج تقييم المبادئ التوجيهية للبحث والتقييم (AGREE II). تضمنت العملية تمثيلاً من مجموعة من أصحاب المصلحة. يشار إلى العلاج المناعي للسم عند الأطفال والبالغين المصابين بالحساسية للوقاية من المزيد من تفاعلات اللدغة الجهازية المتوسطة إلى الشديدة. يوصى أيضًا بالعلاج المناعي للسم عند البالغين الذين يعانون من تفاعلات جلدية عامة فقط لأنه يؤدي إلى تحسينات كبيرة في جودة الحياة مقارنةً بحمل حاقن الأدرينالين الذاتي. يهدف هذا المبدأ التوجيهي إلى تقديم نصائح عملية حول إجراء العلاج المناعي للسم. تغطي الأقسام الرئيسية الاعتبارات العامة قبل بدء العلاج المناعي بالسم ، والتوصيات السريرية القائمة على الأدلة ، وعوامل الخطر للأحداث الضائرة وانتكاس تفاعل اللدغة الجهازية ، وملخصًا للثغرات الموجودة في الأدلة.[12]
ويتجه البحث العلمي الى محاولة ايجاد حل نهائي لمشكلات حساسية النحل ، وقد نشرت ورقة علمية في عام 2019م تحت عنوان: المعرفة الحالية بسم النحل وعلاج تسمم النحل وافادت بأنه يمكن العثور على نحل العسل في جميع أنحاء العالم ويقوم بأدوار التلقيح الرئيسية في أنظمته البيئية الطبيعية ، وكذلك في الزراعة. عادة ما تكون معظم الأنواع سهلة الانقياد ، ومعظم التفاعلات بين البشر والنحل غير إشكالية ، على الرغم من قدرتها على حقن سم معقد في ضحاياها كآلية دفاعية. ومع ذلك ، فإن حوادث لسعات النحل آخذة في الازدياد منذ الإطلاق العرضي للنحل الأفريقي إلى البرازيل في عام 1956 وانتشارها لاحقًا عبر الأمريكتين. تعتبر أنواع هجينة النحل هذه أكثر عدوانية وعرضة للهجوم ، مما يمثل عبئًا كبيرًا على الرعاية الصحية للبلدان التي استعمرها. حتى الآن ، يركز علاج مثل هذه اللسعات عادةً على التحكم في ردود الفعل التحسسية المحتملة ، حيث لا توجد حاليًا مضادات سموم معينة ضد سم النحل. قام الباحثون بالتحقيق في إمكانية تطوير مضادات سم النحل ، ولكن هذا الأمر قد تعقد بسبب انخفاض المناعة الشديد لسموم النحل الرئيسية ، والتي تفشل في إحداث استجابة قوية للأجسام المضادة في الحيوانات المحصنة. ومع ذلك ، مع التقنيات المتطورة الحالية ، مثل عرض الملتهمة ، جنبًا إلى جنب مع ظهور علاجات الأجسام المضادة أحادية النسيلة ، يمكن تطوير مضاد لسم النحل المأشوب ، وقد تم تقرير عن نتائج واعدة نحو هذا الهدف في السنوات الأخيرة. هنا ، تتم مراجعة المعرفة الحالية حول بيولوجيا سم النحل الأفريقي وخيارات العلاج الحالية ضد تسمم النحل. بالإضافة إلى ذلك ، يتم عرض ومناقشة التطورات الأخيرة في الجيل التالي من مضادات سم النحل. [13]

وتشير ورقة علمية نشرت تحت عنوان : تحديد هابتوغلوبين المشقوق في مصل مرضى النحل الذين يعانون من فرط الحساسية ، وتشير الورقة الى أنه تم استخدام سم النحل كمركب علاجي لأمراض بشرية مختلفة في الطب الشرقي، ومع ذلك ، يمكن أن تسبب الحساسية المفرطة في المرضى الذين يعانون من فرط الحساسية أثناء العلاج، حيث أن الحساسية المفرطة هي رد فعل تحسسي حاد يحدث بعد التعرض لمسببات الحساسية، اذ يتم تحرير IgE من الخلايا المرتبطة بالمناعة مثل الخلايا البدينة والخلايا القاعدية أثناء الحساسية المفرطة، ويتم إطلاق وسطاء التهابات مختلفين أيضًا في مجرى الدم أثناء الاستجابة الحادة ، وهدفت الدراسة الى تحديد بروتينات معينة من مرضى سم النحل الذين يعانون من فرط الحساسية، وقام الباحثين بتحليل مصل الدم للمرضى المصابين بسم النحل والمرضى الذين يعانون من فرط الحساسية باستخدام الرحلان الكهربائي ثنائي الأبعاد وأشار التحليل الإحصائي إلى أن وجود البقعة كان معنوياً للغاية في مجموعة سم النحل شديدة الحساسية،والخلاصة أنه تشير النتائج إلى أن الهابتوجلوبين المشقوق قد يكون بروتينًا تشخيصيًا مهمًا للتأق. بالإضافة إلى ذلك ، قد تترافق نسبة عالية من فرط الحساسية لسم النحل مع النمط الجيني الهابتوجلوبين. [14]
وقد تم نشر ورقة علمية مرجعية في عام 2020م عن مسببات الحساسية، والحساسية المفرطة لسم النحل، والاستجابة مناعية، والعلاج المناعي في عام وأفادت بأن سم النحل هو مزيج من المواد الكيميائية الحيوية تتراوح من الببتيدات الصغيرة والإنزيمات إلى الأمينات الحيوية. إنه قادر على إثارة ردود فعل مناعية شديدة بسبب الجزء المسبب للحساسية. يتم تقديم مكونات السم إلى الخلايا التائية بواسطة الخلايا العارضة للمستضد داخل الجلد. ثم تقوم هذه الخلايا من النوع Th2 بإطلاق IL-4 و IL-13 والتي توجه الخلايا البائية لاحقًا إلى تبديل الفئة لإنتاج IgE إن توليد IgE الخاص بالسم و FcεR1 s المتشابك على سطح الخلايا البدينة يكمل مرحلة التحسس لدى الأفراد المصابين بالحساسية الذين من المرجح أن يتعرضوا لتفاعلات حساسية شديدة وحتى قاتلة بعد تعرضهم للسع IgE المحدد لسم النحل هو سيف ذو حدين لأنه وسيط قوي في إثارة الأحداث التحسسية ولكنه يستخدم أيضًا بنجاح في تشخيص السم المصاب بالحساسية، تم إعادة اكتشاف قدرة الشفاء من سم النحل في ظل ظروف يتم التحكم فيها في المختبر باستخدام نماذج حيوانية ومزارع خلوية. كما تمت دراسة الدور المحتمل للجزء الأنزيمي من سم النحل بما في ذلك فسفوليباز A2 في بدء وتطوير الاستجابات المناعية في العديد من البيئات البحثية. مما لا شك فيه ، أن الحصول على نظرة ثاقبة للتفاعلات المناعية بين مكونات سم النحل والخلايا المناعية الفطرية / النوعية على حد سواء محليًا ومنهجيًا سيساهم في تطوير استراتيجيات مناعية في العلاج المناعي المحدد والقائم على الحاتمة خاصة في الأفراد المصابين بحساسية غشائيات الأجنحة. [15]
وقد نشرت دوليا ورقة مرجعية في عام 2020م أيضا وأكدت في ملخصها على أن العلاج المناعي لسم النحل هو الخيار العلاجي الرئيسي لحساسية لسعة النحل. تتمثل حدوده الرئيسية في النسبة العالية من الآثار الجانبية للحساسية وطول المدة ، مما يدفع إلى تطوير طرق علاجية جديدة. تم تقييم ثلاثة مناهج عامة بما في ذلك استخدام مشتقات الحساسية المضادة للحساسية والعلاج المساعد وطرق التسليم البديلة. تستعرض هذه المقالة الأدلة قبل السريرية والسريرية على الإمكانات العلاجية لهذه العلاجات الجديدة. من بين المشتقات المضادة للحساسية ، أظهرت مسببات الحساسية الهجينة انخفاضًا ملحوظًا في تفاعل IgE في نماذج الفئران. ما إذا كانوا سيقدمون فائدة علاجية على المستخلص ، لا يزال الأمر غير معروف لأن التجارب السريرية لم يتم إجراؤها بعد. أثبتت ببتيدات حلقية الخلايا التائية فعاليتها في التجارب السريرية الصغيرة. تم التحايل على قيود الفئة الثانية من معقد التوافق النسيجي الرئيسي باستخدام الببتيدات الحلقية للخلايا التائية طويلة التداخل أو المختلطة. ومع ذلك ، فقد تم تقرير عن الأحداث الضائرة المتأخرة بوساطة الخلايا التائية مع كل من الببتيدات القصيرة والطويلة. يمكن أن يتغلب تطبيق mimotopes على كل من الأحداث الضائرة بوساطة الخلايا التائية والـ IgE. خلال هذا التطور للقاح ، كان هناك زيادة في السلامة. تم تحسين الفعالية بشكل أكبر باستخدام المواد المساعدة لتفعيل مستقبلات تشبه Toll وأنظمة التوصيل. في نماذج الفئران ، أدى ارتباط مسببات الحساسية Api m 1 مع قليل النوكليوتيدات الغنية بالسيتوزين-جوانوزين إلى تحفيز استجابة T-helper type-1 القوية ، في حين أن تغليفها في فقاعات صغيرة يحمي الفئران من تحدي مسببات الحساسية. أظهر إعطاء جرعة منخفضة من اللقاح داخل الوعاء اللمفاوي إمكانية تقليل العلاج من 5 سنوات إلى 12 أسبوعًا فقط. هناك حاجة لتجارب سريرية أكبر لمتابعة هذه النتائج. [16]
تشير احدى الدراسات المنشورة في مجلة السموم (بازل) الدولية في أغسطس عام 2022م والتي نشرت تحت عنوان : يسبب سم النحل التهابًا حادًا من خلال نظام يتوسطه H2O2 يستخدم ديسموتاز فوق أكسيد، وأكدت في مختصرها أنه عادة ما تحفز السموم من المفصليات السامة ، بما في ذلك النحل ، استجابة التهابية موضعية فورية ؛ ومع ذلك ، كيف أن السموم تثير استجابة التهابية حادة والمكونات التي تحفز الاستجابة الالتهابية تظل غير معروفة. علاوة على ذلك ، لم يتم حتى الآن تحديد وجود ديسموتاز الفائق (SOD3) في السم وارتباطه الوظيفي بالاستجابة الالتهابية الحادة. هنا ، أكدنا أن SOD3 في سم النحل (bvSOD3) يعمل كمحفز لإنتاج H2O2 لتعزيز الاستجابات الالتهابية الحادة. في نماذج الفئران ، تسبب bvSOD3 الخارجي في زيادة إنتاج H2O2 بسرعة من خلال الأكسيدات الفائقة التي يتم إنتاجها داخليًا عن طريق الميلتين والفوسفوليباز A2 ، والتي تعمل بعد ذلك على تنشيط تنشيط كاسباس 1 وإفراز الجزيء المسببة للالتهاب وتعزيز الاستجابة الالتهابية الحادة. أظهرنا أيضًا أن التأثير الضار نسبيًا لـ bvSOD3 رفع الاستجابة المناعية من النوع 2 وتمنيع bvSOD3 المحمي ضد الالتهاب الناجم عن السم. تقدم النتائج التي توصلنا إليها نظرة جديدة للآلية الكامنة وراء الالتهاب الحاد الناجم عن سم النحل وتقدم نهجًا جديدًا للعلاجات العلاجية لتسميم النحل ومستحضرات سم النحل للعلاج بالسم / العلاج المناعي. [17]
[1] W. Sieber and M. Brunner, “Hymenoptera venom allergy,” Deutsche Medizinische Wochenschrift, vol. 144, no. 15, pp. 1051–1054, 2019, doi: 10.1055/a-0826-2767.
[2] H. Hirata and Y. Fukushima, “Hymenoptera venom and anaphylaxis hymenoptera venom allergy,” Japanese Journal of Allergology, vol. 67, no. 2, pp. 89–97, 2018, doi: 10.15036/arerugi.67.89.
[3] M. M. Rauber et al., “The honey bee venom allergen Api m 10 displays one major IgE epitope, Api m 10160-174,” Allergy: European Journal of Allergy and Clinical Immunology, vol. 75, no. 7, pp. 1756–1759, Jul. 2020, doi: 10.1111/all.14187.
[4] M. Burzyńska and D. Piasecka‐kwiatkowska, “A review of honeybee venom allergens and allergenicity,” Int J Mol Sci, vol. 22, no. 16, Aug. 2021, doi: 10.3390/ijms22168371.
[5] D. B. K. Golden, “New directions in diagnostic evaluation of insect allergy,” Curr Opin Allergy Clin Immunol, vol. 14, no. 4, pp. 334–339, 2014, doi: 10.1097/ACI.0000000000000072.
[6] U. M. Sahiner and S. R. Durham, “Hymenoptera venom allergy: How does venom immunotherapy prevent anaphylaxis from bee and wasp stings?,” Front Immunol, vol. 10, no. AUG, 2019, doi: 10.3389/fimmu.2019.01959.
[7] L. Carneiro-Leão, L. Amaral, and A. Coimbra, “Reasons for declining venom immunotherapy,” Acta Med Port, vol. 31, no. 11, pp. 618–623, Nov. 2018, doi: 10.20344/amp.9695.
[8] S. Nasser, A. F. Whyte, S. R. Durham, and M. T. Krishna, “Switch-over from Pharmalgen to Alutard Bee and Wasp venom in the UK,” Clinical and Experimental Allergy, vol. 49, no. 12, pp. 1645–1646, Dec. 2019, doi: 10.1111/cea.13529.
[9] K. L. Hon and A. K. C. Leung, “Bee or wasp sting,” Wounds, vol. 29, no. 9, pp. E70–E72, Sep. 2017.
[10] H. Adib-Tezer and C. Bayerl, “Honeybee and wasp venom allergy: Sensitization and immunotherapy,” JDDG – Journal of the German Society of Dermatology, vol. 16, no. 10, pp. 1228–1247, Oct. 2018, doi: 10.1111/ddg.13670.
[11] K. Gortzak and R. A. Gortzak, “[Wasp and bee stings].,” Ned Tijdschr Tandheelkd, vol. 120, no. 7–8, pp. 373–376, 2013.
[12] G. J. Sturm et al., “EAACI guidelines on allergen immunotherapy: Hymenoptera venom allergy,” Allergy: European Journal of Allergy and Clinical Immunology, vol. 73, no. 4, pp. 744–764, Apr. 2018, doi: 10.1111/all.13262.
[13] M. B. Pucca et al., “Bee Updated: Current Knowledge on Bee Venom and Bee Envenoming Therapy,” Front Immunol, vol. 10, Sep. 2019, doi: 10.3389/fimmu.2019.02090.
[14] J. M. Ryu, H. H. Na, J. S. Park, B. S. Ahn, and K. C. Kim, “Identification of Cleaved Haptoglobin in the Serum of Bee Venom-Hypersensitive Patients,” JAMS Journal of Acupuncture and Meridian Studies, vol. 14, no. 3, pp. 102–109, 2021, doi: 10.51507/j.jams.2021.14.3.102.
[15] D. Elieh Ali Komi, F. Shafaghat, and R. D. Zwiener, “Immunology of Bee Venom,” Clin Rev Allergy Immunol, vol. 54, no. 3, pp. 386–396, Jun. 2018, doi: 10.1007/s12016-017-8597-4.
[16] A. Zahirović, J. Luzar, P. Molek, N. Kruljec, and M. Lunder, “Bee Venom Immunotherapy: Current Status and Future Directions,” Clin Rev Allergy Immunol, vol. 58, no. 3, pp. 326–341, Jun. 2020, doi: 10.1007/s12016-019-08752-x.
[17] K. S. K. Y. Lee et al., “Bee Venom Induces Acute Inflammation through a H2O2-Mediated System That Utilizes Superoxide Dismutase,” Toxins (Basel), vol. 14, no. 8, Aug. 2022, doi: 10.3390/toxins14080558.