دكتور أمجد هزاع
دكتور أمجد هزاع
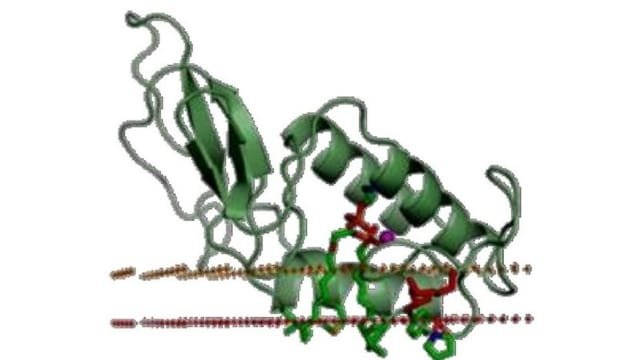
يتكون سم النحل من العديد من المواد الفعالة وهي مركبات ببتيدية بروتينية انزيمية لها تأثيرات فسيولوجية متعددة أهمها هي مادة الميليتين (اضغط هنا للتعرف عليها) والتي تشكل ما يقارب %50-55 من نسبة المادة الجافة لسم النحل بالاضافة الى مادة الفوسفوليبيز A2 ، وفيما يلي توضيح لأهم مكونات سم النحل و تركيب سم النحل الكيميائي :
تعتبر مادة الفوسفوليبيز A2 هي المادة الثانية من حيث الأهمية في تركيب سم نحل العسل وتعتبر انزيمية مزيبة للفوسفوليبيدات Enzyme hydrolyzing Phospholipids وتشكل ما يقارب 10-12 % من السم الجاف ولها فوائد فسيولوجية عظيمة على صحة الانسان.

يعتبر الفوسفوليبيز A2 أهم مكونات سم النحل العلاجية بعد الميليتين، وتصنيع ppc مختلط السلسلة ، ويقلل الفوسفوليبيز من ضغط الدم ، لأنه يقوم بتكسير الفوسفوليبيدات ، كما يقلل لزوجة الدم ويقلل عملية تجلط الدم ، وله العديد من التأثيرات البيولوجية كما تؤكد الأوراق العلمية.[1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11], [12]
و تحث مادة فوسفوليباز A2 بسم النحل مجموعات الخلايا التائية التنظيمية عن طريق قمع مسار إشارات موت الخلايا المبرمج Bee Venom Phospholipase A2 Induces Regulatory T Cell Populations by Suppressing Apoptotic Signaling Pathway. ولها أهمية كبيرة .[13]
– يعمل فوسفوليبيز سم النحل (BV) على علاج العديد من الأمراض ويسبب نشاطًا مضادًا للالتهابات، ومضادًا للبكتيريا، ومضادًا للطفرات، ومضادًا للأشعة، ومضادًا لاضطرابات المناعة، ومضادًا للألم، ونشاطًا يقي خلايا الكبد ومضادًا للسرطان، وفقًا للأبحاث والمراجع العلمية ، يحتوي سم النحل على العديد من الإنزيمات ، بما في ذلك phospholipase A2 (PLA2) و phospholipase B و hyaluronidase و acid phosphatase ومادة α-glucosidase .[1], [2], [3], [4], [5], [6], [8], [9], [10], [11], [13], [14], [15], [16], [17], [18], [19], [20], [21], [22], [23], [24] ويؤكد الاستشاري الدكتور أمجد هزاع على أن مادة فوسفوليبيز سم النحل BV PLA2 تعمل على تخفيف الأمراض التنكسية العصبية والأمراض الالتهابية والربو.

– مادة فوسفوليبيز من أهم مركبات سم النحل التي لها تأثير مضاد للألم ومسكن قوي كما أشادت الأبحاث والأوراق العلمية. [9], [29], [30]
يؤكد الدكتور أمجد هزاع على الآلية المتوقعة للتأثير المسكن بوساطة الفوسفوليبيز bvPLA2 ، حيث يزيد bvPLA2 الخلايا العصبية النورادرينالية في بعض المواضع ويسهل إطلاق النورأدرينالين (NA) في الحبل الشوكي، ويعمل على تنشيط α1-AR في GABAergic interneuron في القرن الظهري للحبل الشوكي بواسطة NA ، مما يمنع انتقال الإشارات المسببة للألم.
كما يعمل هذا الانزيم على الفوسفوليبدات مثل اللسيثين حيث يحللها إلى جزئين الأول حامض دهنى والجزء الثانى هو الليزولسيثين Lysolcithine والذى يحلل كرات الدم الحمراء ويغير شكل البروتوبلازم فى الخلايا فيسبب انفصال البروتين الدهنى Lipoprotien على هيئة رقائق داخل الخلايا, كما يساعد على انتشار مكونات سم النحل داخل الأنسجة .[9], [19], [29], [31] يتم إدخال Phospholipase A2 في سم النحل في جلد الإنسان ويشق الفسفوليبيدات في كل مكان إلى أحماض دهنية حرة وليزوفوسفوليبيدات تعمل كمستضدات مستحدثة. هذه المستضدات الجديدة للأحماض الدهنية متاحة الآن لأخذ عينات من خلايا لانجرهانز البشرة ، والتي تحملها على بروتينات CD1a وتقدمها على سطحها إلى خلايا CD1a المتفاعلة في الجلد. تنتج هذه الخلايا التائية السيتوكينات مثل IL-22 التي تساهم في الاستجابة الالتهابية.[2], [9], [19], [29], [31], [32], [33]
– وما أجمل التعبير حين نشرت ورقة علمية مرجعية بعنوان: سم النحل عدو الأمس أصبح صديق اليوم.[9] وأفادت الورقة العلمية المنشورة دوليا بانه يستخدم علاج سم النحل في علاج الأمراض المتعلقة بالمناعة مثل التهاب المفاصل لفترة طويلة. في الآونة الأخيرة ، كشفت أن المجموعة الثالثة إفرازي فسفوليباز A2 من سم النحل (سم النحل المجموعة III sPLA2) لها تأثيرات مناعية في المختبر وفي الجسم الحي، وأظهر عدد متزايد من التقارير التأثيرات العلاجية لمجموعة سم النحل III sPLA2. والجدير بالذكر أن البيانات التجريبية الجديدة أظهرت استجابات مناعية وقائية لمجموعة سم النحل III sPLA2 ضد مجموعة واسعة من الأمراض بما في ذلك الربو ومرض باركنسون والتهاب الأعضاء الناجم عن الأدوية. ومن الأهمية بمكان تقييم الآثار المفيدة والضارة لمجموعة سم النحل III sPLA2 لأن هذا الإنزيم المسبب الرئيسي للحساسية لسم النحل الذي يمكن أن يسبب صدمة الحساسية. لعقود عديدة ، بذلت الجهود لتجنب آثاره الضارة في التركيزات العالية ، يمكن أن يؤدي التعرض لسم النحل من المجموعة الثالثة sPLA2 إلى تلف الأغشية الخلوية وموت الخلايا الميتة. وقامت الورقة بتلخيص المعرفة الحالية حول التأثيرات العلاجية لمجموعة سم النحل III sPLA2 على العديد من الأمراض المناعية ووصفنا الآليات التفصيلية لمجموعة سم النحل III sPLA2 في تنظيم الاستجابات المناعية المختلفة والتغيرات الفيزيولوجية المرضية.

يعتبر من أكثر مكونات سم النحل حساسية. [24] حيث قد يتسبب في الالتهاب والتحسس عند بعض المرضى ويعتبر أكثر مكونات سم النحل خطورة ، ولذلك يرجى التعامل مع العلاج بسم النحل من قبل الأطباء المتخصصون.
[1] R. Nomura et al., “Bee venom phospholipase A2-induced phasic contractions in mouse rectum: Independent roles of eicosanoid and gap junction proteins and their loss in experimental colitis,” Eur J Pharmacol, vol. 718, no. 1–3, pp. 314–322, 2013, doi: 10.1016/j.ejphar.2013.08.015.
[2] H. V. K. Nidamarthi, M. Choudhury, and D. Velmurugan, “Understanding the binding mechanism of succinic acid against phospholipase A2 from bee venom,” J Biochem Mol Toxicol, vol. 35, no. 4, Apr. 2021, doi: 10.1002/jbt.22715.
[3] G. H. Kang et al., “Bee venom phospholipase A2 ameliorates atherosclerosis by modulating regulatory T cells,” Toxins (Basel), vol. 12, no. 10, Oct. 2020, doi: 10.3390/toxins12100609.
[4] J. Singh and R. Ranganathan, “Surface dilution kinetics of phospholipase A2 catalyzed lipid-bilayer hydrolysis,” Journal of Physical Chemistry B, vol. 118, no. 8, pp. 2077–2083, Feb. 2014, doi: 10.1021/jp411512c.
[5] H. Kim, D. J. Keum, J. W. Kwak, H. S. Chung, and H. Bae, “Bee venom phospholipase A2 protects against acetaminophen-induced acute liver injury by modulating regulatory T cells and IL-10 in mice,” PLoS One, vol. 9, no. 12, Dec. 2014, doi: 10.1371/journal.pone.0114726.
[6] H. Baek et al., “Bee venom phospholipase A2 ameliorates Alzheimer’s disease pathology in Aβ vaccination treatment without inducing neuro-inflammation in a 3xTg-AD mouse model,” Sci Rep, vol. 8, no. 1, Dec. 2018, doi: 10.1038/s41598-018-35030-1.
[7] M. Zhao, U. T. Brunk, and J. W. Eaton, “Delayed oxidant-induced cell death involves activation of phospholipase A2,” FEBS Lett, vol. 509, no. 3, pp. 399–404, Dec. 2001, doi: 10.1016/S0014-5793(01)03184-2.
[8] A. Babon et al., “Bee venom phospholipase A2 as a membrane-binding vector for cell surface display or internalization of soluble proteins,” Toxicon, vol. 116, pp. 56–62, Jun. 2016, doi: 10.1016/j.toxicon.2015.07.338.
[9] G. Lee and H. Bae, “Bee venom phospholipase A2: Yesterday’s enemy becomes today’s friend,” Toxins (Basel), vol. 8, no. 2, Feb. 2016, doi: 10.3390/TOXINS8020048.
[10] H. Jo et al., “The responsiveness of bee venom phospholipase a2 on regulatory t cells correlates with the cd11c+ cd206+ population in human peripheral blood mononuclear cells,” Toxins (Basel), vol. 13, no. 10, Oct. 2021, doi: 10.3390/toxins13100717.
[11] G. M. Choi et al., “Bee venom phospholipase A2 alleviates collagen-induced polyarthritis by inducing Foxp3+ regulatory T cell polarization in mice,” Sci Rep, vol. 11, no. 1, Dec. 2021, doi: 10.1038/s41598-021-82298-x.
[12] S. M. Borowitz and C. Montgomery, “The role of phospholipase A2 in microsomal lipid peroxidation induced with t-butyl hydroperoxide,” Biochem Biophys Res Commun, vol. 158, no. 3, pp. 1021–1028, Feb. 1989, doi: 10.1016/0006-291X(89)92824-6.
[13] H. Baek et al., “Bee venom phospholipase A2 induces regulatory T cell populations by suppressing apoptotic signaling pathway,” Toxins (Basel), vol. 12, no. 3, 2020, doi: 10.3390/toxins12030198.
[14] H. Jeong, C. Lee, C. Cheng, H. C. Chou, H. J. Yang, and H. Bae, “Targeting of adipose tissue macrophages by bee venom phospholipase A2 attenuates high-fat diet-induced obesity,” Int J Obes, vol. 45, no. 8, pp. 1656–1667, Aug. 2021, doi: 10.1038/s41366-021-00823-4.
[15] N. W. Palm, R. K. Rosenstein, S. Yu, D. D. Schenten, E. Florsheim, and R. Medzhitov, “Bee venom phospholipase A2 induces a primary type 2 response that is dependent on the receptor ST2 and confers protective immunity,” Immunity, vol. 39, no. 5, pp. 976–985, Nov. 2013, doi: 10.1016/j.immuni.2013.10.006.
[16] D. Shin, W. Choi, and H. Bae, “Bee venom phospholipase A2 alleviate house dust mite-induced atopic dermatitis-like skin lesions by the CD206 mannose receptor,” Toxins (Basel), vol. 10, no. 4, Apr. 2018, doi: 10.3390/toxins10040146.
[17] C. Almunia et al., “Bee Venom Phospholipase A2, a Good ‘Chauffeur’ for Delivering Tumor Antigen to the MHC I and MHC II Peptide-Loading Compartments of the Dendritic Cells: The Case of NY-ESO-1,” PLoS One, vol. 8, no. 6, Jun. 2013, doi: 10.1371/journal.pone.0067645.
[18] A. S. Alekseeva, P. E. Volynsky, N. A. Krylov, V. P. Chernikov, E. L. Vodovozova, and I. A. Boldyrev, “Phospholipase A2 way to hydrolysis: Dint formation, hydrophobic mismatch, and lipid exclusion,” Biochim Biophys Acta Biomembr, vol. 1863, no. 1, Jan. 2021, doi: 10.1016/j.bbamem.2020.183481.
[19] S. Woo, G. Chung, H. Bae, and S. K. Kim, “Suppressive effects of bee venom-derived phospholipase a2 on mechanical allodynia in a rat model of neuropathic pain,” Toxins (Basel), vol. 11, no. 8, Aug. 2019, doi: 10.3390/toxins11080477.
[20] M. Ye et al., “Bee venom phospholipase A2 ameliorates motor dysfunction and modulates microglia activation in Parkinson’s disease alpha-synuclein transgenic mice,” Exp Mol Med, vol. 48, no. 7, Jul. 2016, doi: 10.1038/EMM.2016.49.
[21] G. Lux, J. Mansfeld, and R. Ulbrich-Hofmann, “Phospholipase A2-catalyzed acylation of lysophospholipids analyzed by experimental design,” Enzyme Microb Technol, vol. 64–65, pp. 60–66, 2014, doi: 10.1016/j.enzmictec.2014.07.003.
[22] L. F. Leandro et al., “Antimicrobial activity of apitoxin, melittin and phospholipase A2 of honey bee (Apis mellifera) venom against oral pathogens,” An Acad Bras Cienc, vol. 87, no. 1, pp. 147–155, Mar. 2015, doi: 10.1590/0001-3765201520130511.
[23] T. A. Jepson, S. C. Hall, and J. K. Chung, “Single-molecule phospholipase A2 becomes processive on melittin-induced membrane deformations,” Biophys J, vol. 121, no. 8, pp. 1417–1423, Apr. 2022, doi: 10.1016/j.bpj.2022.03.019.
[24] P. Soltan-Alinejad, H. Alipour, D. Meharabani, and K. Azizi, “Therapeutic Potential of Bee and Scorpion Venom Phospholipase A2 (PLA2): A Narrative Review,” Iran J Med Sci, vol. 47, no. 4, pp. 300–313, Jul. 2022, doi: 10.30476/ijms.2021.88511.1927.
[25] I. Caramalho et al., “Bee venom enhances the differentiation of human regulatory T cells,” Allergy: European Journal of Allergy and Clinical Immunology, vol. 70, no. 10, pp. 1340–1345, Oct. 2015, doi: 10.1111/all.12691.
[26] C. Chliva, X. Aggelides, M. Makris, A. Katoulis, D. Rigopoulos, and E. Tiligada, “Comparable profiles of serum histamine and IgG4 levels in allergic beekeepers,” Allergy: European Journal of Allergy and Clinical Immunology, vol. 70, no. 4, pp. 457–460, Apr. 2015, doi: 10.1111/all.12568.
[27] A. Kocyigit, E. M. Guler, and S. Kaleli, “Anti-inflammatory and antioxidative properties of honey bee venom on Freund’s Complete Adjuvant-induced arthritis model in rats,” Toxicon, vol. 161, pp. 4–11, Apr. 2019, doi: 10.1016/j.toxicon.2019.02.016.
[28] J. M. Ryu, H. H. Na, Y. J. Park, J. S. Park, B. S. Ahn, and K. C. Kim, “Sweet Bee Venom Triggers Multiple Cell Death Pathways or Spurs Acute Cell Rupture According to Its Concentration in THP-1 Monocytic Leukemia Cells,” Genes (Basel), vol. 13, no. 2, Feb. 2022, doi: 10.3390/genes13020223.
[29] D. Li, Y. Lee, W. Kim, K. Lee, H. Bae, and S. K. Kim, “Analgesic effects of bee venom derived phospholipase A2 in a mouse model of oxaliplatin-induced neuropathic pain,” Toxins (Basel), vol. 7, no. 7, pp. 2422–2434, Jun. 2015, doi: 10.3390/toxins7072422.
[30] W. Kim, “Bee Venom and Its Sub-Components: Characterization, Pharmacology, and Therapeutics,” Toxins (Basel), vol. 13, no. 3, Mar. 2021, doi: 10.3390/TOXINS13030191.
[31] J. Choi et al., “Suppressive effects of bee venom acupuncture on paclitaxel-induced neuropathic pain in rats: Mediation by spinal α2-adrenergic receptor,” Toxins (Basel), vol. 9, no. 11, Nov. 2017, doi: 10.3390/toxins9110351.
[32] N. Shi et al., “Venom composition and pain-causing toxins of the Australian great carpenter bee Xylocopa aruana,” Sci Rep, vol. 12, no. 1, Dec. 2022, doi: 10.1038/s41598-022-26867-8.
[33] A. Nakashima et al., “Phospholipase A2 from bee venom increases poly(I:C)-induced activation in human keratinocytes,” Int Immunol, vol. 32, no. 6, pp. 371–383, Mar. 2020, doi: 10.1093/intimm/dxaa005.